Rappel urgent de médicament - Teva Octreotide pour suspension injectable
Rappel urgent de médicament
Teva Octreotide pour suspension injectable
(DIN 02503751, 02503778, 02503786)
Toronto, Canada (10 janvier 2026) – Teva Canada Limitée procède à un rappel volontaire de type I du produit Teva Octréotide pour suspension injectable (10 mg, 20 mg et 30 mg par flacon, à libération prolongée; DIN 02503751, 02503778 et 02503786) en raison de préoccupations potentielles liées à la qualité, découlant de déficiences relatives aux bonnes pratiques de fabrication (BPF) relevées dans un site tiers. À ce jour, Teva Canada Limitée n’a reçu aucun rapport de plainte ni d’effet indésirable associé aux lots faisant l’objet du rappel.
Produits faisant l’objet du rappel
Les produits touchés sont les suivants :
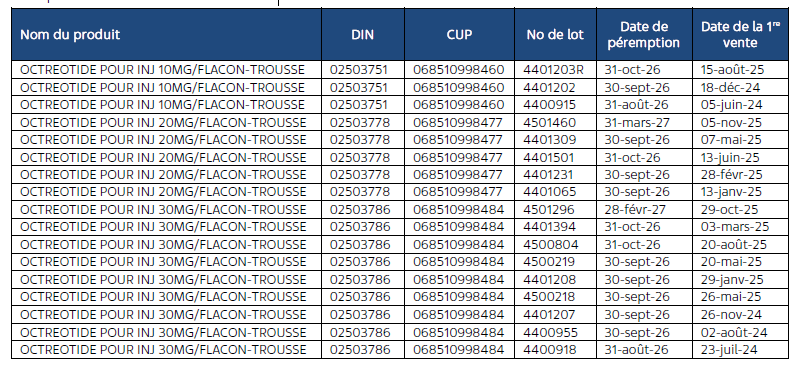
Le produit
• Médicament injectable délivré sur ordonnance, fourni sous forme de trousse à dose unique pour administration intramusculaire.
Contenu de la trousse :
- Une fiole à dose unique contenant la dose prescrite d’octréotide (sous forme d’acétate d’octréotide) sous forme de poudre lyophilisée pour suspension.
- Une seringue préremplie contenant le diluant (environ 2 ml) destiné à la reconstitution de la poudre.
- Un adaptateur de fiole facilitant le transfert du diluant dans la fiole du médicament.
- Une aiguille stérile pour injection (souvent une aiguille de sécurité de calibre 19 et de 1,5 po).
- Une notice d’instructions pour la préparation et l’administration.
Quoi faire
Les consommateurs ayant acheté Teva Octreotide sont priés de vérifier le numéro de lot figurant sur l’étiquette du produit. Si le numéro de lot correspond à l’un de ceux indiqués ci-dessus, il est recommandé de retourner le produit à la pharmacie ou au point de vente où il a été acheté et d’obtenir un produit de remplacement ou une alternative.
Teva Canada Limitée avise ses distributeurs, détaillants et professionnels de la santé afin d’organiser le retour et/ou le crédit des lots rappelés. Les distributeurs et les détaillants qui détiennent des stocks du produit visé ont été informés de cesser immédiatement toute distribution, d’isoler les quantités restantes sous leur contrôle et de retourner les lots rappelés à Teva Canada Limitée.
Questions de nature médicale ou effets secondaires
La présente communication destinée au grand public ne constitue pas un avis médical. Afin de bien comprendre les répercussions possibles de cette information sur votre santé, il est important de consulter un médecin ou un autre professionnel de la santé.
La gestion des effets indésirables liés aux produits de santé commercialisés repose sur leur déclaration par les professionnels de la santé et les consommateurs. Tout effet secondaire inattendu observé chez des patients utilisant Teva Octreotide doit être signalé à Teva Canada Limitée et/ou à Santé Canada.
Coordonnées
Teva Canada Limitée
Affaires médicales et renseignements sur les médicaments
30, Novopharm Court
Toronto (Ontario) M1B 2K9
1-800-268-4127, option 3
druginfo@tevacanada.com
Demandes des médias
Bureau des affaires publiques
public.affairs@tevacanada.com
Santé Canada
Vous pouvez signaler tout effet indésirable présumé associé à l’utilisation de produits de santé à Santé Canada via le Programme Canada Vigilance :
Sans frais : 1‑866‑234‑2345
En ligne : www.canada.ca/medeffect
Par télécopieur : 1‑866‑678‑6789
Teva Canada Limitée
Teva s’engage à améliorer la santé en offrant des traitements innovants ainsi que des médicaments génériques et biosimilaires de qualité. Entreprise d’envergure mondiale, Teva dessert plus de 200 millions de patients chaque jour. Au Canada, cela représente plus de 175 000 ordonnances exécutées quotidiennement avec un produit de Teva. Depuis 60 ans, Teva Canada fait partie intégrante du quotidien des familles canadiennes en proposant des solutions de soins de santé accessibles et novatrices, y compris des programmes essentiels de soutien aux patients. Pour de plus amples renseignements, veuillez consulter le site www.tevacanada.com.